1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
Podmiot odpowiedzialny i wytwórca odpowiedzialny za zwolnienie serii:
FATRO S.p.A., Via Emilia 285 – 40064 Ozzano Emilia (BO), Włochy
2. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Fatroximin Intrauterine Foam 100 mg / 13,4 g aerozol domaciczny dla bydła i koni
3. ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
1 opakowanie 13,4 g zawiera:
Rifaksymina 100 mg
4. WSKAZANIA LECZNICZE
Leczenie ostrych i chronicznych bakteryjnych stanów zapalnych dróg rodnych u krów, jałówek i klaczy: endometritis, metritis, cervicitis, vulvovaginitis, pyometra wywołanych przez patogenne mikroorganizmy wrażliwe na rifaksyminę, takie jak bakterie Gram-dodatnie oraz liczne szczepy bakterii Gram-ujemnych, w tym beztlenowce (A. pyogenes, Staphylococcus spp., Streptococcus spp., E. coli, Clostridium spp., Bacteroides spp. i Fusobacterium spp.).
5. PRZECIWWSKAZANIA
Nie stosować w przypadku nadwrażliwości na substancję czynną lub jakąkolwiek substancję pomocniczą produktu.
6. DZIAŁANIA NIEPOŻĄDANE
Nie stwierdzono.
O wystąpieniu działań niepożądanych po podaniu tego produktu lub zaobserwowaniu jakichkolwiek niepokojących objawów nie wymienionych w ulotce (w tym również objawów u człowieka na skutek kontaktu z lekiem), należy powiadomić właściwego lekarza weterynarii, podmiot odpowiedzialny lub Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Formularz zgłoszeniowy należy pobrać ze strony internetowej http://www.urpl.gov.pl (Pion Produktów Leczniczych Weterynaryjnych).
7. DOCELOWE GATUNKI ZWIERZĄT
Bydło, koń.
8. DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
Krowy i jałówki:
– ostry i chroniczny stan zapalny błony śluzowej macicy, zapalenie szyjki macicznej: 50-200 mg rifaksyminy jednorazowo wewnątrzmacicznie tj. odpowiednio ½ – 2 pojemników po 13,4 g, w zależności od wielkości macicy, którą kontrolujemy podczas badania rektalnego,
– zapalenie pochwy i warg sromowych: 100 mg (1 pojemnik) dopochwowo, powtórzyć podanie w tej samej dawce po 24 godz.,
– ropomacicze: 50-200 mg (½ – 2 pojemników) wewnątrzmacicznie, po uprzednim usunięciu z jamy macicy wydzieliny ropnej.
Klacze:
– ostry i chroniczny stan zapalny błony śluzowej macicy: 100-400 mg jednorazowo odpowiednio (1-4 pojemników), w zależności od wielkości macicy.
Aplikacja preparatu może być powtórzona w zależności od stanu narządu rodnego, który ocenia lekarz weterynarii.
W zależności od decyzji lekarza weterynarii, podanie produktu można powtórzyć po 24-48 godzinach od pierwszego podania. Jeżeli terapia jest nieskuteczna, dalsze stosowanie produktu nie jest wskazane.
9. ZALECENIA DLA PRAWIDŁOWEGO PODANIA
Preparat podawać po uprzednim zastosowaniu PGF2α lub jej analogu w celu wywołania lizy ciałka żółtego (jeżeli występuje) i otwarcia szyjki macicy, a następnie usunięciu z jamy macicy wydzieliny ropnej.
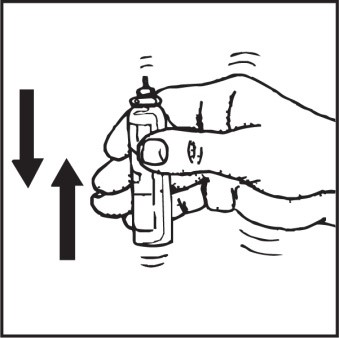
Przed użyciem dokładnie wstrząsnąć pojemnik z preparatem.
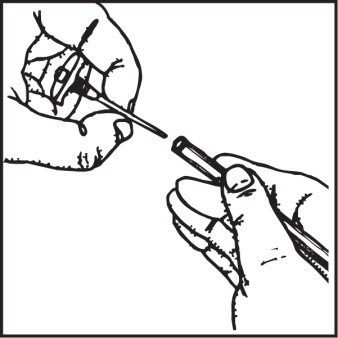
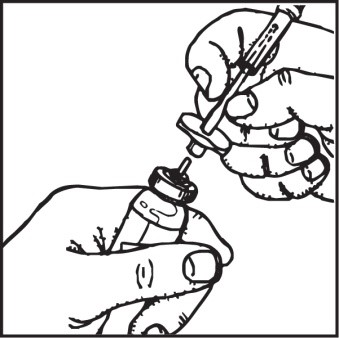
1. Nałożyć na zewnętrzny koniec katetera domacicznego łącznik znajdujący się
w opakowaniu.
2. Do łącznika wprowadzić załączoną końcówkę rozpylającą.
3. Wprowadzić kateter do macicy.
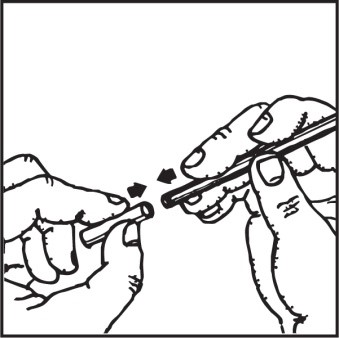
4. Dokładnie wstrząsnąć pojemnik z preparatem i podłączyć do końcówki rozpylającej
ustawiając go pionowo do podłoża.
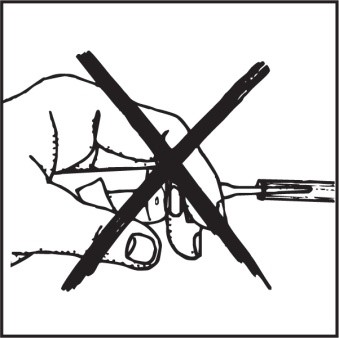
Błędem jest ustawienie pojemnika z preparatem równolegle lub skośnie do podłoża.
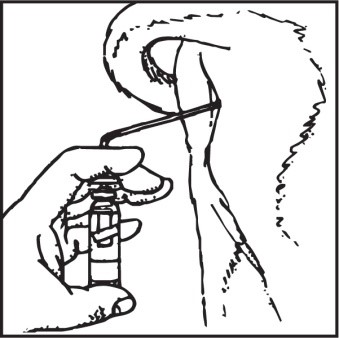
Po wprowadzeniu do macicy aerozol tworzy pianę o 6-krotnej większej objętości niż pojemnik ciśnieniowy.
INSTRUKCJA STOSOWANIA:
 |
 |
 |
 |
|
Połączyć kateter z łącznikiem
lub wprowadzić dozownik bezpośrednio do katetera
|
Wprowadzić dozownik do łącznika
|
Energicznie wstrząsnąć pojemnikiem
|
Założyć dozownik połączony
z kateterem na pojemnik
|
 |
 |
 |
|
|
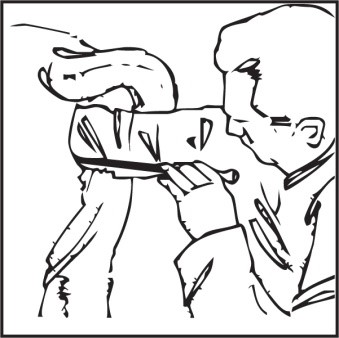
Wprowadzić kateter przez
szyjkę macicy do jej jamy
|
Ustawić dozownik tak, aby pojemnik z preparatem tworzył kąt prosty z kateterem
|
ŹLE!!! Nie trzymać pojemnika poziomo w czasie aplikacji preparatu
|
|
10. OKRES KARENCJI
Bydło: Tkanki jadalne: zero dni.
Mleko: zero dni.
Konie kiedykolwiek leczone produktem FATROXIMIN Intrauterine Foam nie mogą zostać przeznaczone do uboju w celach spożycia przez ludzi. Stosować wyłącznie u koni, które w paszporcie mają podpisaną deklarację „nie jest przeznaczony do uboju w celach spożywczych (konsumpcji przez ludzi) zgodnie z obowiązującym prawem”.
11. SZCZEGÓLNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Brak specjalnych środków ostrożności dotyczących przechowywania.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na etykiecie.
12. SPECJALNE OSTRZEŻENIA
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Produkt powinien być stosowany w oparciu o wyniki testu oporności bakterii wyizolowanych od chorych zwierząt. Jeśli nie jest to możliwe, leczenie powinno być prowadzone w oparciu o lokalne informacje epidemiologiczne dotyczące wrażliwości izolowanych bakterii.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom:
Nie wdychać aerozolu, chronić przed nim oczy.
Pojemnik pod ciśnieniem: chronić przed słońcem i nagrzaniem powyżej temperatury 50° C.
Nie przekłuwać ani nie spalać, także po użyciu. Chronić przed dziećmi.
Ciąża:
Nie stosować przez całość okresu trwania ciąży.
Laktacja:
Preparat może być stosowany w okresie laktacji.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki):
Produkt podawany w zalecanych dawkach jest dobrze tolerowany.
Podanie nadmiernej ilości piany może spowodować uszkodzenie ścian macicy.
Niezgodności farmaceutyczne:
Ponieważ nie wykonywano badań dotyczących zgodności, tego produktu leczniczego weterynaryjnego nie wolno mieszać z innymi produktami leczniczymi weterynaryjnymi.
13. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
Leków nie należy usuwać do kanalizacji ani wyrzucać do śmieci.
O sposoby usunięcia bezużytecznych leków zapytaj lekarza weterynarii. Pozwolą one na lepszą ochronę środowiska.
14. DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
28/11/2014
15. INNE INFORMACJE
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego, należy kontaktować się z lokalnymi przedstawicielami podmiotu odpowiedzialnego.
FATRO POLSKA Sp. z o.o.
ul. Bolońska 1, 55-040 Kobierzyce
telefon: 071 311 11 11
telefaks: 071 311 11 82
e-mail: office@fatro-polska.com.pl
Dostępne opakowania:
Pudełko tekturowe zawierające 6 pojemników ciśnieniowych po 13,4 g.